Quá trình đẳng áp
{{#invoke:Sidebar |collapsible
| bodyclass = plainlist
| titlestyle = padding-bottom:0.3em;border-bottom:1px solid #aaa;
| title = Nhiệt động lực học
| imagestyle = display:block;margin:0.3em 0 0.4em;
| image =
| caption = Động cơ nhiệt Carnot cổ điển
| listtitlestyle = background:#ddf;text-align:center;
| expanded =
| list1name = các nhánh | list1title = Các nhánh | list1 = Bản mẫu:Flatlist
| list2name = định luật | list2title = Nguyên lý | list2 = Bản mẫu:Flatlist
| list3name = hệ | list3title = Hệ thống nhiệt động | list3 =
Bản mẫu:Thanh bên
| list4name = thuộc tính hệ | list4title = Thuộc tính hệ
| list4 =
Bản mẫu:Thanh bên
| list5name = vật liệu | list5title = Tính năng vật liệu | list5 =
| list6name = phương trình | list6title = Phương trình | list6 = Bản mẫu:Flatlist
| list7name = Thế nhiệt động | list7title = Thế nhiệt động | list7 = Bản mẫu:Flatlist
Bản mẫu:Endflatlist Bản mẫu:Danh sách không dấu đầu dòng
| list8name = lịch sử/văn hóa | list8title = Bản mẫu:Hlist | list8 =
Bản mẫu:Thanh bên
| list9name = nhà khoa học | list9title = Nhà khoa học | list9 = Bản mẫu:Flatlist
- Bernoulli
- Boltzmann
- Carnot
- Clapeyron
- Clausius
- Carathéodory
- Duhem
- Gibbs
- von Helmholtz
- Joule
- Maxwell
- von Mayer
- Onsager
- Rankine
- Smeaton
- Stahl
- Thompson
- Thomson
- Waterston
| below = Sách
}} Quá trình đẳng áp (tiếng Anh: isobaric process) là 1 quá trình nhiệt động lực học trong đó áp suất là 1 hằng số (không đổi theo thời gian). Theo nguyên lý 1 nhiệt động lực học:
Theo định luật 1 về nhiệt động lực học, nếu thể tích của khí tăng lên thì công được sinh ra do sự dãn ra (tăng thể tích) của khí, cụ thể như sau:
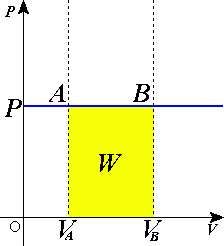
Trong chất khi lý tưởng: trong đó n là số mol khí, R là hằng số khí lý tưởng
nên [1]
Vậy ta có được biểu thức
Liên hệ giữa nhiệt dung mol đẳng tích và đẳng áp
Dựa vào quá trình đẳng tích, giữa quá trình không có sự truyền nhiệt của các phản ứng hóa học, ta thu được sự liên hệ giữa độ thay đổi nội năng phụ thuộc vào nhiệt độ như sau:
với là nhiệt dung mol khi thể tích không đổi [2] Với là số bậc tự do của phân tử khí
Khi áp suất không đổi, với là nhiệt dung mol khi áp suất không đổi.
Từ định luật 1 nhiệt động lực học ta có:
Tham khảo
- ↑ Bản mẫu:Chú thích web
- ↑ Principles of Physics, trang 621